ควอซินอยด์
ควอซินอยด์
ชื่อสามัญ Quassinoids
ประเภทและข้อแตกต่างควอซินอยด์
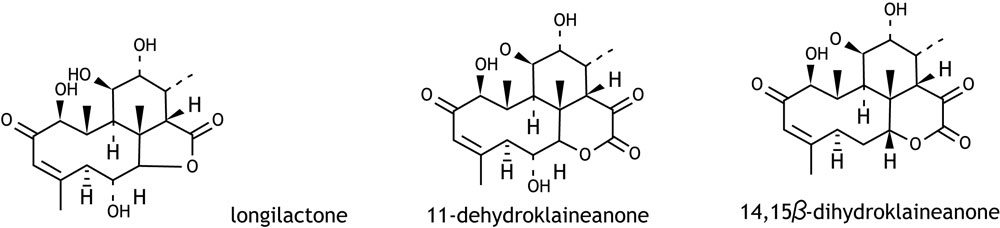
ควอซินอยด์(Quassinoids) เป็นชื่อกลุ่มของสารที่ได้จากพืชธรรมชาติ ชนิดหนึ่งที่มีโครงสร้างคล้ายกับโครงสร้างแบบ tirucallane ของสารกลุ่มไตรเทอร์ปีนอยด์ (triterpenoids) ซึ่งสารกลุ่มนี้จะ มีวิถีชีวสังเคราะห์ (Biosynthetic pathway) แบบ mevalonic acid pathway เช่นเดียวกับสารตั้งต้นของสารกลุ่ม triterpenoids สำหรับประเภทของสารควอซินอยด์ นั้น จากการศึกษาค้นคว้าพบว่า สามารถแยกออกไปได้อีกมากกว่า 150 ชนิด อาทิเช่น eurycomanol 6-dehydrorurycomalactone, eurycomalactone, 10-hydroxycathin-6-one, 6-hydroxy-5-eurycomaone, eurycolactone A, eurycolactone B, eurycolactone C, eurycolactone D และ laurycolactone B, eurycolactone E, eurycolactone F, 14, 15β-dihydroxyklaineanone, longilactone และ 2, 3-dehydro-4α-hydroxy-longilactone เป็นต้น
แหล่งที่พบและแหล่งที่มาควอซินอยด์
สารกลุ่มควอซินอยด์ (Quassiniods) เป็นกลุ่มของสารที่สามารถพบได้ในธรรมชาติ แต่จะพบได้เฉพาะพืชสกุล Simaroubaceae อาทิเช่น ปลาไหลเผือก (Eurycoma longifolia Jack) และราชดัด (Brucea javanica) ซึ่งในปัจจุบันนิยมสกัดสารดังกล่าวจากส่วนต่างๆ ของปลาไหลเผือก (Eurycoma longifolia Jack) ซึ่งสารในกลุ่มควอซินอยด์ (Quassinoids) ในส่วนต่างๆ ของปลาไหลเผือกนั้นจะเป็นสารที่ให้รสขมแก่สมุนไพรชนิดนี้นั่นเอง

ปริมาณที่ควรได้รับควอซินอยด์
สำหรับปริมาณและขนาด ของสารกลุ่มควอซินอยด์ (Quassinoids) ที่สามารถใช้ได้อย่างปลอดภัยต่อวันนั้น จากการศึกษาค้นคว้าพบว่ายังไม่มีการกำหนดถึงขนาดและปริมาณในการใช้สารดังกล่าวแต่อย่างใด ส่วนการใช้และการได้รับสารควอซินอยด์จะเป็นการใช้ในรูปแบบสมุนไพร จากพืชที่เป็นแหล่งของสารกลุ่มดังกล่าวทั้งในการใช้เป็นสมุนไพรเดี่ยวหรือนำไปผสมกับสมุนไพรอื่นๆ รวมถึงยังมีการใช้ในรูปแบบสารสกัดหยาบ (crude extract) จากพืชที่เป็นแหล่งของสารกลุ่มดังกล่าว โดยมีขนาดการใช้ในรูปแบบสารสกัดหยาบในรูปแบบสมุนไพร คือไม่ควรเกิน วันละ 400 มิลลิกรัม/วัน และไม่ควรใช้ต่อเนื่องกันเกิน 3 เดือนอีกด้วย
ประโยชน์และโทษควอซินอยด์
การใช้ประโยชน์จากสารกลุ่มควอซินอยด์ (Quassinoids) จากสมุนไพรปลาไหลเผือกในปัจจุบัน จะเป็นการใช้ในรูปแบบสารสกัดหยาบ (crude extract) ทั้งในรูปแบบใช้เดี่ยวๆ หรือใช้เป็นส่วนประกอบหรือส่วนผสมของตำรายาต่างๆ อาทิเช่น ยาจันทร์ลีลา ยาสามราก และยาประสะเหมือดคน เป็นต้น นอกจากนี้ยังมีผลการศึกษาวิจัยพบว่า สารกลุ่มควอซินอยด์ (Quassinoids) มีฤทธิ์ช่วยเพิ่มสมรรถภาพทางเพศ ต้านการอักเสบ เพิ่มกระบวนการสร้างอสุจิ ต้านไวรัส ลดความวิตกกังวล ลดน้ำตาลในเลือด ช่วยลดไข้ มีฤทธิ์ต้านเชื้อมาลาเรีย และปรสิต ต้านมะเร็งและเซลล์เนื้องอก เป็นต้น
การศึกษาวิจัยที่เกี่ยวข้องควอซินอยด์
จากการรวบรวมและสืบค้นงานวิจัยฤทธิ์ทางเภสัชวิทยาของสารกลุ่มควอซินอยด์ พบว่ามีฤทธิ์ทางเภสัชวิทยา ดังนี้
ฤทธิ์ต่อสมรรถภาพทางเพศและฮอร์โมน (effect of Eurycoma longifolia on sexual performance and hormones) สารสกัดมาตรฐานจากรากปลาไหลเผือก TAF 273 ที่ประกอบด้วยสาร eurycomanone และ13α,21-dihydroeurycomanone สามารถลดความผิดปกติของโรคทางระบบสืบพันธุ์ที่กระตุ้นด้วยฮอร์โมนเทสโทสเตอโรนในหนูเพศเมียได้ โดยหนูเพศเมียที่ได้รับฮอร์โมนเทสโทสเตอโรนขนาด 10 mg/kg ทุกวันเป็นเวลา 3 สัปดาห์ จะมีอาการผิดปกติของรอบฮอร์โมนเอสโตรเจนและเกิดถุงนำของเซลล์ไข่ในรังไข่ (ovarian cysticfollicles) ในหนูกลุ่มที่ได้รับสารสกัด TAF 273 จะมีจำนวนหนูที่มีอาการผิดปกติของรอบฮอร์โมนเอสโตรเจน จำนวนน้อย และมีเซลล์ไข่ที่มีโครงสร้างถูกทำลายลดลง ซึ่งแสดงว่าสารกลุ่ม quassinoids มีฤทธิ์ต้านเอสโตรเจน (anti-estrogenic property) และยังมีการศึกษาผลของสารสกัดปลาไหลเผือกที่สกัดด้วยนำภายใต้ความดันสูงตามเอกสารสิทธิบัตรเลขที่ US 7,132,117 B2 ซึ่งมีปริมาณของ eurycomanone อยู่ 1.604% ต่อป้องกันการละลายของกระดูก (bone resorption) เนื่องจากการขาดฮอร์โมนเพศชาย (androgen) พบว่าเมื่อให้สารสกัดขนาด 15 mg/kg ต่อวันในหนูที่ถูกตัดอัณฑะเป็นเวลา 6 สัปดาห์พบว่า มีปริมาณฮอร์โมนเทสโทสเตอโรนเพิ่มขึ้นอย่างมีนัยสำคัญค่าบ่งชี้ การละลายของกระดูกมีค่าลดลงอย่างมีนัยสำคัญ (p < 0.05) เมื่อเปรียบเทียบกับก่อนได้รับสารสกัดและมีการแสดงออกของยีนที่สร้างโปรตีน osteoprotegerin มากขึ้น ซึ่งเกี่ยวข้องกับการยับยั้งการละลายของกระดูก
นอกจากนี้ในหนูเพศผู้ที่ได้รับสารสกัด F2 ที่ได้จากการแยกสารสกัดหยาบเมทานอลจากรากปลาไหลเผือกด้วย HP20 resin ซึ่งมีสาร eurycomanone เป็นสารสำคัญ ขนาด 25 mg/kg ต่อวัน เป็นเวลา 48 สัปดาห์ พบว่ามีความเข้มข้นของตัวอสุจิเพิ่มมากข้น มีปริมาณของ spermatocyte และปริมาณของ spermatid ระยะที่ 7 ในกระบวนการสร้างตัวอสุจิ (spermatogenesis cycle) เพิ่มมากขึ้น เมื่อเปรียบเทียบกับหนูในกลุ่มควบคุมอย่างมีนัยสำคัญ (p < 0.05) มีอัตราการสร้าง spermatozoa เพิ่มมากขึ้น มี Leydig cell เพิ่มมากขึ้นมีระดับฮอร์โมนเทสโทสเตอโรนเพิ่มมากขึ้น มีระดับฮอร์โมน LH (Luteinizing Hormone) และ FSH (Follicle Stimulating Hormone) เพิ่มมากขึ้น มีระดับฮอร์โมนเอสโตรเจนลดลง โดยสาร eurycomanone และ13α-dihydroeurycomanone ในสารสกัด F2 มีฤทธิ์เพิ่มปริมาณเทสโทสเตอโรนที่สร้างจาก Leydig cell (in vitro) ได้อย่างมีนัยสำคัญ (p < 0.05) ซึ่งจากผลการทดลองแสดงว่าสารสกัด F2 จากรากปลาไหลเผือกที่มีสาร eurycomanone เป็นสารสำคัญทำให้สร้างตัวอสุจิได้มากขึ้น โดยผ่านการควบคุมของ hypothalamicpituitary-gonadal axis นอกจากนี้ สาร eurycomanone ยังเพิ่มการสร้างฮอร์โมน เทสโทสเตอโรนของ Leydig cell โดยการยับยั้งเอนไซม์ aromatase ที่เปลี่ยนฮอร์โมนเทสโทสเตอโรนให้เป็นเอสโตเจน และสารสกัดในปริมาณที่สูงอาจจะสามารถยับยั้งเอนไซม์ phosphodiesterase ได้
ฤทธิ์ต้านเซลล์มะเร็ง (anti-cancer activity) มีการศึกษาวิจัยพบว่าสารกลุ่ม quassinoids ได้แก่ 6α-hydroxyeurycomalactone, longilactone, 14, 15βdihydroxyklaineanone, 11-dehydroklaineanone,eurycomalactone, 5, 6-dehydroeurycomalatone มีฤทธิ์ความเป็นพิษต่อเซลล์ P388 (leukemia cell) และ KB (mouth epidermal carcinoma cells) ในหลอดทดลอง ส่วนสาร 6-dehydroxylongilactone และ 7α-hydroxyeurycomalactone มีความเป็นพิษต่อเซลล์ P388 โดยมีค่า IC50 เท่ากับ 0.66 และ 0.11 µg/ml ตามลำดับ สาร 14,15β-dihydroxyklaineanone มีฤทธิ์ยับยั้งการเกิดเนื้องอก (tumor) ที่กระตุ้นโดยเชื้อไวรัส Epstein-Barr โดยมีค่า IC50 เท่ากับ 5 µM และสาร eurycomanone มีความเป็นพิษต่อเซลล์มะเร็งตับ (human hepatocarcinoma cells, HepG2) โดยชักนำให้เซลล์มะเร็งตับเกิดกระบวนการ apoptosis ซึ่งเกี่ยวข้องกับการ up-regulation ของโปรตีน p53 (tumor suppressor protein) การเพิ่มข้นของโปรตีน Bax (pro-apoptotic protein) และการลดลงของโปรตีน Bcl-2 (anti-apoptotic protein) นอกจากนี้สารกลุ่ม quassinoids ยังมีความเป็นพิษต่อ metastatic HT-1080 human fibrosarcoma cell line โดยเฉพาะ eurycomalactone (IC50 เท่ากับ 0.98 µM) 14,15β-dihydroxyklaineanone (IC50 เท่ากับ 1.1 µM) 13,21-dihydroeurycomanone (IC50 เท่ากับ 0.93 µM) ขณะที่ 5-fluorouracil และ doxorubicin ที่ใช้ในเป็น positive control มีค่า IC50 เท่ากับ 5.2 และ 0.53 µM ตามลำดับ
ฤทธิ์ต้านการอักเสบ (anti-inflammatory activity) สาร eurycomalactone, 13, 21-dehydroeurycomanone และ 14, 15β-dihydroklaieanone มีฤทธิ์ยับยั้ง NF-κB โดยมีค่า IC50 เท่ากับ 0.5, 0.7 และ 1.0 µM ตามลำดับ จากผลการศึกษาพบว่าสารกลุ่ม C19 quassinoids เช่น eurycomalactone, 7α-hydroxyeurycomalactone (IC50 เท่ากับ 1.5 µM) และ eurycolacton E (IC50 เท่ากับ 3.8 µM), C20 quassinoids เช่น 13, 21-dehydroeurycomanone, 14, 15β-dihydroklaieanone และ 11-dehydroklaieanone (IC50 เท่ากับ 1.9 µM), canthin-6-one alkaloids เช่น 9-hydroxycanthin-6-one (IC50 เท่ากับ 3.8 µM) และ β-carboline alkaloids คือ 1-methoxycarbonyl- β-carboline (IC50 เท่ากับ 29.3 µM) มีฤทธิ์ยับยั้ง NF-κB ในขณะที่สารกลุ่ม C18 quassinoids, สารกลุ่มฟีนอลิค (phenolic compounds), สารกลุ่มคูมาริน (coumarins), สาร squalene derivative และสารกลุ่ม triterpenoids ไม่มีฤทธิ์ยับยั้ง NF-κB ที่ความเข้มข้น 30 µM
ฤทธิ์ต้านมาลาเรียและปรสิต (anti-malarial and antiparasite activities) สาร eurycomanol-2-O-β-D-glycopyranoside และ eurycomanol มีฤทธิ์ต้านเชื้อ Plasmodium falciparum (Gombak A strain) โดยมีค่า IC50 เท่ากับ 1.590+0.169 และ 1.544+0.137 µg/ml ตามลำดับ ซึ่งมีฤทธิ์น้อยกว่า chloroquine (IC50 เท่ากับ 0.144+0.042 µg/ml) และ quinine (IC50 เท่ากับ 0.069+0.001 µg/ml) สาร 11-dehydroklaineanone, 15β-hydroxyklaineanone และ 14, 15βdihydroxyklaineanone มีฤทธิ์ฆ่าเชื้อพลาสโมเดียม โดยมีค่า IC50 เท่ากับ 5.3, 5.3 และ 5.0 µM ตามลำดับ และสารกลุ่ม quassinoids จากรากปลาไหลเผือกได้แก่ eurycomanone, 13, 21-dihydroeurycomanone, 13α(21)-epoxyeurycomanone และ eurycomalactone และสาร 9-methoxycanthin-6-one มีฤทธิ์ต้านเชื้อ P. falciparum สายพันธุ์ Gombak A โดยมีค่า IC50 เท่ากับ 0.56, 0.71, 1.06, 4.48 และ 3.76 µM ตามลำดับ นอกจากนี้ยังมีรายงานการศึกษาความเป็นพิษระบุว่า
การศึกษาความเป็นพิษควอซินอยด์
จากการศึกษาความเป็นพิษแบบเฉียบพลันของสารสกัดรากปลาไหลเผือก (Eurycoma longifolia Jack) ซึ่งมีสาร quassinoids เป็นสารสำคัญในการออกฤทธิ์ พบว่าขนาดที่ทำให้หนูแรทเพศผู้และเพศเมียตายครึ่งนึง (LD50) คือ 1,293 และ > 2,000 มก./กก.น้ำหนักตัว ตามลำดับ และการศึกษาต่อระบบสืบพันธุ์ของหนูแรททั้งเพศผู้และเพศเมียโดยป้อนรากปลาไหลเผือก ขนาด 10, 25 และ 100 มก./กก.น้ำหนักตัว พบว่ารากปลาไหลเผือกมีผลเพิ่มดัชนีชี้วัดการเจริญพันธุ์ของหนูแรทเพศผู้ เมื่อได้รับสารสกัดนานติดต่อกัน 28 วัน และมีช่วยลดเปอร์เซนต์การสูญเสียศักยภาพในการฝังตัวของตัวอ่อน ทั้งก่อนและหลังกระบวนการฝังตัว (pre-implantation loss and post-implantation loss) ลดการฝ่อของตัวอ่อนในครรภ์ (late resorption) ในหนูแรทเพศเมียที่ได้รับสารสกัดติดต่อกัน 14 วัน ไม่พบอาการความเป็นพิษอื่นๆ และไม่พบความความผิดปกติต่อทารกในครรภ์ แสดงให้เห็นว่าขนาดสูงที่สุดของรากปลาไหลเผือกซึ่งได้รับทุกวันแล้วไม่ทำให้เกิดความเป็นพิษหรือผลเสียใดๆ ต่อร่างกาย (no-observed-adverse-effect level: NOAEL) คือ 100 มก./กก.น้ำหนักตัว ซึ่งมีค่าต่ำกว่าค่า LD50 ถึง 10 เท่า
ส่วนอีกการศึกษาหนึ่งระบุว่าการศึกษาความเป็นพิษเฉียบพลันของสารสกัดเอทานอล 34% และสารสกัดน้ำจากรากปลาไหลเผือกที่มีสารกลุ่มควอซินอยด์ (Quassinoids) เป็นสารออกฤทธิ์หลัก โดยการป้อนให้ทางปากพบว่า ค่าความเข้มข้นที่ทำให้หนูเม้าส์ตายครึ่งหนึ่ง (LD50) มีค่าเท่ากับ 1,500-2,000 และมากกว่า 3,000 มก./กก. น้ำหนักตัว ตามลำดับ (22) และเมื่อทดสอบด้วยวิธีการฉีดเข้าช่องท้องพบว่า สารสกัดลำดับส่วนบิวทานอลที่แยกจากสารสกัดเอทานอล 50% มีความเป็นพิษมากที่สุด โดยสารที่มีความเป็นพิษมากที่สุดคือ eurycomanone
ข้อแนะนำและข้อควรปฏิบัติ
ในการใช้สารกลุ่ม Quassinoids ซึ่งเป็นสาระสำคัญที่ออกฤทธิ์ในปลาไหลเผือก ซึ่งหากได้รับในปริมาณที่พอดีก็เป็นประโยชน์ต่อร่างกายแต่หากได้รับมากเกินไปก็อาจก่อให้เกิดโทษได้ ซึ่งมีข้อควรระวังดังนี้
- ไม่ควรใช้ในปริมาณมากเกิน 400 มก./วัน และไม่ควรใช้ติดต่อกันเกิน 3 เดือน เพราะอาจส่งผลเสียต่อตับได้
- สตรีมีครรภ์หรือสตรีให้นมบุตร และเด็กเล็กไม่ควรรับประทาน เนื่องจากยังไม่มีรายงานความปลอดภัย
- ผู้ป่วยที่ใช้ยารักษาความดันโลหิตสูง propanolol ควรหลีกเลี่ยง เนื่องจากมีรายงานการวิจัยระบุว่า สารสกัดรากปลาไหลเผือกมีผลยับยั้งการดูดซึมของยาดังกล่าว
- ควรระมัดระวังการใช้ร่วมกับยารักษาโรคเบาหวาน เพราะสารกลุ่มดังกล่าวมีฤทธิ์ลดน้ำตาลในเลือดซึ่งอาจเสริมฤทธิ์ยาจนทำให้เกิดอันตรายต่อร่างกายได้
- ควรระมัดระวังการใช้ร่วมกับยาสลายลิ่มเลือดหรือยาป้องกันการแข็งตัวของเลือด เช่น วาฟฟารินและแอสไพริน เพราะอาจเสริมฤทธิ์ยาจนทำให้เกิดอันตรายต่อร่างกายได้
เอกสารอ้างอิง ควอซินอล
- พิชานันท์ ลีแก้ว. ปลาไหลเผือก...สมุนไพรสำหรับสุภาพบุรุษ. สำนักงานข้อมูลสมุนไพร คณะเภสัชศาสตร์ มหาวิทยาลัยมหิดล
- รศ.ดร.ภญ.อ้อมบุญ วัลลิสุต. สมุนไพรสำหรับเบาหวาน. บทความเผยแพร่ความรู้สู่ประชาชน.สำนักงานข้อมูลสมุนไพร คณะเภสัชศาสตร์ มหาวิทยาลัยมหิดล
- นิจศิริ เรืองรังษี, ชัยศักดิ์ จันศรีนิยม, นิรันดร์ วิพันธุ์เงิน. รายงานฉบับสมบูรณ์. การศึกษาวิจัยสมุนไพรปลาไหลเผือก เพื่อประเมินค่าและความสำคัญประกอบพิจารณาในการประกาศให้เป็นสมุนไพรควบคุมตามพระราชบัญญัติคุ้มครองและส่งเสริมภูมิปัญญาการแพทย์แผนไทย. 49 หน้า
- การศึกษาความเป็นพิษของปลาไหลเผือก. ข่าวความเคลื่อนไหวสมุนไพร. สำนักงานข้อมูลสมุนไพร คณะเภสัชศาสตร์ มหาวิทยาลัยมหิดล
- Chan KL, Lee SP, Sam TW, Tan SC, Noguchi H, Sankawa U. 13β,18-dihydroeurycomanol, a quassinoid from Eurycoma longifolia. Phytochemistry. 1991;30(9):3138–41.
- Chan KL, Lee S, Sam TW, Han BH. A quassinoid glycoside from the roots of Eurycoma longifolia. Phytochemistry. 1989;28(10):2857–9.
- Jiwajinda S, Santisopasri V, Murakami A, Kawanaka M, Kawanaka H, Gasquet M, et al. In vitro anti-tumor promoting and anti-parasitic activities of the quassinoids from Eurycoma longifolia, a medicinal plant in Southeast Asia. Journal of Ethnopharmacology. 2002;82(1):55–8.
- Bhat R, Karim AA. Tongkat Ali (Eurycoma longifolia Jack): a review on its ethnobotany and pharmacological importance. Fitoterapia. 2010; 81(7): 669-79.
- Tran TVA, Malainer C, Schwaiger S, Atanasov AG, Heiss EH, Dirsch VM, et al. NF-κB Inhibitors from Eurycoma longifolia. Journal of Natural Products. 2014;77(3):483–8.
- Ang HH, Hitotsuyanagi Y, Takeya K. Eurycolactones A–C, novel quassinoids from Eurycoma longifolia. Tetrahedron Letters. 2000;41(35):6849–53.
- Abdulghani M, Hussin AH, Sulaiman SA, Chan KL. The ameliorative effects of Eurycoma longifolia Jack on testosterone-induced reproductive disorders in female rats. Reproductive Biology. 2012;12(2):247–55.
- Salman SA, Amrah S, Wahab MS, Ismail Z, Ismail R, Yuen KH, et al. Modification of propranolol's bioavailability by Eurycoma longifolia water-based extract. J Clin Pharm Ther. 2010; 35(6): 691-6.
- Zakaria Y, Rahmat A, Pihie AHHL, Abdullah NR, Houghton PJ. Eurycomanone induce apoptosis in HepG2 cells via up-regulation of p53. Cancer Cell International. 2009;9(1):1–21.
- Teh C-H, Morita H, Shirota O, Chan K-L. 2,3-Dehydro-4α-hydroxylongilactone, a novel quassinoid and two known phenyl propanoids from Eurycoma longifolia Jack. Food Chemistry. 2010;120(3):794–8.
- Low B-S, Choi S-B, Abdul Wahab H, Kumar Das P, Chan K-L. Eurycomanone, the major quassinoid in Eurycoma longifolia root extract increases spermatogenesis by inhibiting the activity of phosphodiesterase and aromatase in steroidogenesis. Journal of Ethnopharmacology. 2013;149(1):201–7.
- Satayavivad J, Soonthornchareonnon N, Somanabandhu A, Thebtaranonth Y. Toxicological and antimalarial activity of eurycomalactone and Eurycoma longifolia Jack extracs in mice. Thai J Phytopharm. 1998; 5(2): 14-24.
- Shuid AN, El-arabi E, Effendy NM, Razak HSA, Muhammad N, Mohamed N, et al. Eurycoma longifolia upregulates osteoprotegerin gene expression in androgen- deficient osteoporosis rat model. BMC Complementary and Alternative Medicine. 2012;12:152.
- Shahida AN, Wongb TW, and Choo CY. Hypoglycemic effect of quassinoids from Brucea javanica (L.) Merr (Simaroubaceae) seeds, Journal of Ethnopharmacology, 2009; 124(3):586-591. Available online 9 May 2009 doi:10.1016/j.jep.2009.04.058.
- Miyake K, Tezuka Y, Awale S, Li F, Kadota S. Quassinoids from Eurycoma longifolia. Journal of Natural Products. 2009;72(12):2135–40.
- Ang HH, Hitotsuyanagi Y, Fukaya H, Takeya K. Quassinoids from Eurycoma longifolia. Phytochemistry. 2002;59(8):833–7.
- Itokawa H, Kishi E, Morita H, Takeya K. Cytotoxic quassinoids and Tirucallane-type triterpenes from the woods of Eurycoma longifolia. Chemical and Pharmaceutical Bulletin. 1992;40 (4):1053–55.