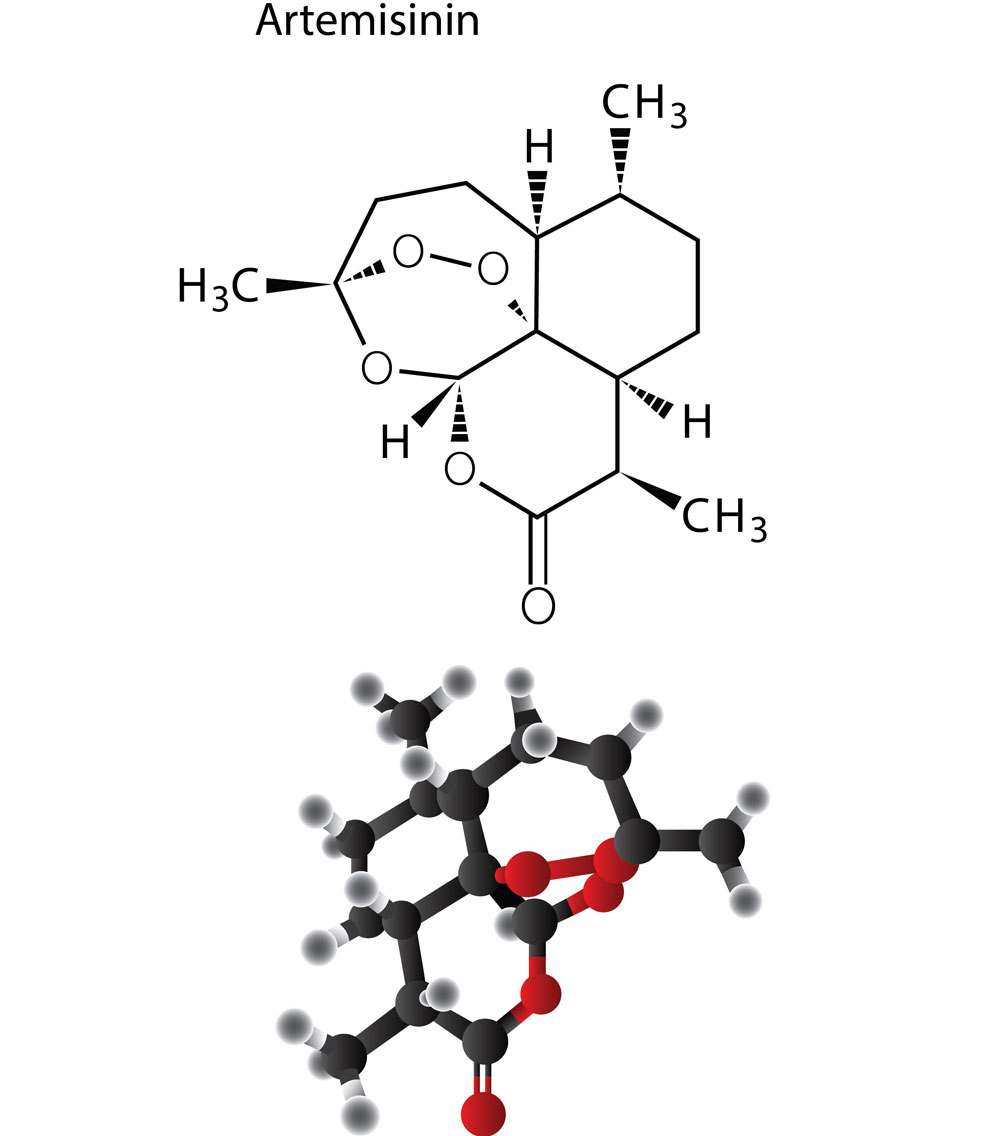
อาร์ทีมิชินิน
อาร์ทีมิชินิน
ชื่อสามัญ Artemisinin, Qinghaosu
ประเภทและข้อแตกต่างของอาร์ทีมิชินิน
อาร์ทีมิชินิน (Artemisinin) หรือ Qing hoa เป็นสาระสำคัญที่สกัดได้จากพืชธรรมชาติมีโครงสร้างทางเคมีเป็น sesquiterpene lactone โดยมีพันธะเอนโดเปอร์ออกไซด์ (-O-O-) เป็นส่วนที่สำคัญ และมีสูตรทางเคมีคือ C15H22O5 มีมวลโมเลกุล 282.332 g/mol ละลายได้ไม่ดีทั้งในน้ำและน้ำมัน ถูกค้นพบครั้งแรกในประเทศจีนเมื่อ ค.ศ.1972 สำหรับประเภทของอาร์ทีมิชินิน นั้น จากการศึกษาค้นคว้าพบว่ามีเพียงชนิดเดียวเท่านั้น แต่ทั้งนี้ในปัจจุบันได้มีการสังเคราะห์อนุพันธ์ของอาร์ทีมิชินิน (artemisinin) ขึ้นมาเพื่อให้มีความสะดวกในการใช้ประโยชน์อีกหลายชนิด เช่น artessunate, dihydroartemisinin, artemether และ arteether เป็นต้น
แหล่งที่พบและแหล่งที่มาของอาร์ทีมิชินิน
ดังที่ได้กล่าวมาแล้วว่า อาร์ทีมิชินิน (Artemisinin) เป็นสารในกลุ่ม sesquiterpene lactone ที่สามารถพบได้ในธรรมชาติ โดยสามารถพบได้ในโกฐจุฬาลัมพา (ชนิด Artemisia annua) ชื่อสามัญ sweet warmwood หรือชื่อในภาษาจีนเรียกว่า ชิงเฮา (qinghao) ซึ่งเป็นพืชสมุนไพรจีนที่ใช้เป็นยาแผนโบราณมานานกว่า 2000 ปี โดยสามารถพบได้ในส่วนของใบ ลำต้นสีเขียวขนาดเล็ก ดอกและเมล็ดของต้นโกศจุฬาลัมพา อีกทั้งยังมีรายงานการศึกษาวิจัยพบว่าในส่วนเหนือดินของโกฐจุฬาลัมพาที่ทำการเพาะปลูกในแอฟริกา มีปริมาณ artemisinin 0.63-0.70% ของน้ำหนักแห้ง และเมื่อนำมาเตรียมในรูปแบบชาชงพบว่าสามารถสกัดสาร artemisinin ได้ถึง 40% ของทั้งหมด จากการทดลองโดยใช้ใบแห้ง 5 กรัม ต่อน้ำ 1 ลิตร นอกจากนี้ในปัจจุบันยังมีการสังเคราะห์อนุพันธุ์ของอาร์ทีมิชินิน (artemisinin) ขึ้นมาใช้ประโยชน์ทางการแพทย์เนื่องจาก อาร์ทีมิชินินค่อนข้างมีปัญหาการเตรียมในรูปแบบยาต่างๆ เนื่องจากคุณสมบัติละลายได้ไม่ดีทั้งในน้ำและในน้ำมัน โดยการสังเคราะห์ดังกล่าวจะใช้อาร์ทีมิชินินเป็นสารตั้งต้นแล้วจัดการการเปลี่ยนแปลงที่หมู่ตรงคาร์บอนตำแหน่งที่ 10 เพื่อให้ได้สารที่มีคุณสมบัติละลายน้พและน้ำมันได้ดี เช่น artesunate, dihydroartemisinin, artemether และ arttether เป็นต้น
.jpg)
ปริมาณที่ควรได้รับจากอาร์ทีมิชินิน
สำหรับการใช้อาร์ทีมิชินิน (artemisinin) ในปัจจุบันหลักๆ แล้วจะเป็นการใช้เพื่อบำบัดรักษาโรคมาลาเรียโดยมีขนาดและปริมาณ ของอาร์ทีมิชินิน (Artemisinin) ที่ใช้ได้อย่างปลอดภัยและใช้กันในประเทศไทยในปัจจุบันดังนี้
ขนาดการใช้ยาต้านมาลาเรีย
|
ยา |
มาลาเรียชนิดไม่รุนแรง (ยารับประทาน) |
มาลาเรียชนิดรุนแรง (ยาฉีด) |
|
Artesunate |
ใช้ร่วมกับ mefloquine 25 มก./กก. โดยแบ่งให้ 12 มก./กก. ภายในเวลา 3-5 วัน (ตัวอย่างเช่น 4 มก./กก. เป็นเวลา 3 วันหรือ 4 มก./กก. ตามด้วย 2มก./กก. ต่อวัน เป็นเวลา 4 วัน); ถ้าใช้เพียงชนิดเดียวให้ใช้ติดต่อกัน 7 วัน (มักเริ่มด้วย 4 มก./กก. ตามด้วย 2 มก./กก. ต่อวัน) |
2.4 มก./กก. IV หรือ IM ทันที ตามด้วย 1.2 มก./กก. เมื่อครบ 12 และ 24 ชั่วโมง จากนั้นให้ทุกวัน |
|
Artemether |
เช่นเดียวกับ artesunate |
3.2 มก./กก. IM ทันที ตามด้วย 1.6 มก./กก. ต่อวัน |
คำย่อ: IM, intramuscular; SC, subcutaneous; IV, intravenous; ECG, electrocardiogram; G6PD, glucose-6-phosphate dehydrogenase
ประโยชน์และโทษของอาร์ทีมิชินิน
ดังที่ได้กล่าวมาแล้วว่าการนำอาร์ทีมิชินิน (Artemisinin) มาใช้ประโยชน์โดยหลักๆ แล้วจะเป็นการนำมาใช้เพื่อบำบัดรักษาโรคมาลาเรียโดย อาร์ทีมิชินินและอนุพันธุ์สามารถฆ่าเชื้อมาลาเรียได้ทุกชนิด รวมทั้งมาลาเรียสายพันธุ์ดื้อยาต้านมาลาเรียชนิดอื่นๆ ดังนั้นจึงมีการใช้อย่างแพร่หลายในถิ่นที่มีการระบาดของโรคมาลาเรียรวมทั้งประเทศไทย และยังพบว่ามีผลข้างเคียงต่ำ ซึ่งอาร์ทีมิชินินนั้นจะมีกระบวนการแมแทบอลิซึมและเภสัชจลนศาสตร์ ดังนี้ เมื่อยากลุ่มอาร์ทีมิชินินถูกดูดซึมเข้าสู่ร่างกาย ส่วนใหญ่เปลี่ยนรูปโดยเอนไซม์ไซโตโครมพี 450 (cytochrome P450) เป็น dihydroartemisinin ซึ่งมีฤทธิ์ฆ่าเชื้อมาลาเรียได้ดีกว่า Artemisinin บริสุทธิ์ถึง 100 เท่า โดยมีค่าครึ่งชีวิตในการกำจัด (t1/2elimination) เพียง 45 นาที และ dihydroartemisinin ในปริมาณมากกว่า 90% จะเข้าจับกับโปรตีนในกระแสโลหิต (plasma protein) และสำหรับ artesunate ในรูปแบบรับประทานจะมีชีวอนุเคราะห์ (bioavailability) ประมาณ 60% ในผู้ติดเชื้อมาลาเรีย โดยเวลาที่พบความเข้มข้นสูงสุดในรูป dihydroartemisinin ในช่วงเวลา 1-2 ชั่วโมง ส่วนยาเตรียมในรูปแบบรับประทานของ artemisinin dihydromisinin และ artemether นั้น ไม่มีค่าชีวอนุเคราะห์สัมบูรณ์เพราะไม่มียาเตรียมรูปยาฉีดเข้าหลอดเลือดดำแต่สามารถกำจัดเชื้อมาลาเรียในคนไข้อย่างรวดเร็วสอดคล้องกับการดูดซึมและการกำจัดยาอย่างรวดเร็ว นอกจากนี้ยังมีรายงานการศึกษาวิจัยในต่างประเทศที่ได้ระบุถึงฤทธิ์ทางเภสัชวิทยาอื่นๆ ของอาร์ทีมิชินินว่ามีฤทธิ์ทางชีวภาพที่หลากหลาย เช่น สารต้านมะเร็ง ต้านการอักเสบ แก้ปวด แก้อักเสบ ยับยั้งแบคทีเรีย ปรสิตและแมลง เป็นต้น
การศึกษาวิจัยที่เกี่ยวข้องของอาร์ทีมิชินิน
มีรายงานผลการศึกษาวิจัยทางเภสัชวิทยาของอาร์ทีมิชินิน (artemisinin) ดังนี้
ฤทธิ์ต้านเชื้อมาลาเรีย มีการทดสอบฤทธิ์ต้านเชื้อมาลาเรียในหลอดทดลอง ของใบโกฐจุฬาลัมพา (A. annua) ที่ได้จากแหล่งต่างๆ ของประเทศบราซิล โดยวิธีการแช่ (infusion) เตรียมสารทดสอบโดยใช้ผงใบ 5 กรัม แช่สกัดในน้ำเดือด ปิดฝา และตั้งทิ้งไว้เป็นเวลา 15 นาที แล้วนำไปกรอง ทดสอบสารสกัดเพื่อดูความไวของสารทดสอบต่อเชื้อ Plasmodium falciparum สายพันธุ์ K1 และ 3d7 ที่แยกได้จากประเทศบราซิล ซึ่งดื้อต่อยาคลอโรควีน แต่ไวต่อยาควินิน และอาร์ทีมิซินิน ผลการทดสอบพบว่าใบโกฐจุฬาลัมพาจาก 4 แหล่ง มีปริมาณของอาร์ทีมิซินิน อยู่ระหว่าง 0.90-1.13% ความเข้มข้นของอาร์ทีมิซินินที่ได้จากการแช่สกัดใบ อยู่ในช่วง 40-46 mg/L ผลจากการทดสอบพบว่าสารสกัดใบด้วยวิธีการแช่สกัดจากทั้ง 4 แหล่ง ออกฤทธิ์ดีในการยับยั้งเชื้อ P. falciparum สายพันธุ์ K1 และ 3d7 โดยมีค่า IC50 ต่ำ อยู่ระหว่าง 0.08-0.10 และ 0.09-0.13 μL/mL ตามลำดับ
ส่วนอีกการศึกษาวิจัยหนึ่งมีการศึกษาวิจัยสาร Duhydroartemisinin ซึ่งเป็น active metabolite ของ artesunate และ artemether ซึ่งเป็นอนุพันธุ์ของ artemisinin โดยพบว่าตัวยาดังกล่าวถูกกำจัดได้รวดเร็ว มีค่าครึ่งชีวิตน้อยกว่า 1 ชั่วโมง และการศึกษาในเด็กเวียดนาม 10 คน ที่ป่วยเป็นมาลาเรีย falciparum และให้รับประทานยาเม็ด artesunate ขนาด 3 mg/kg พบระดับยาสูงสุดในเลือดมีปริมาณเฉลี่ยของ Dihydroartemisinin เท่ากับ 664 ng/ml และมีการดูดซึมเร็วมากโดยมีค่าเฉลี่ยเวลาที่ระดับยาในเลือดสูงสุดเท่ากับ 1.7 ชั่วโมง การกำจัดยามีค่าครึ่งชีวิตเฉลี่ย 1 ชั่วโมง นอกจากนี้ยังพบว่ายากลุ่ม Artemisinin (artesunate, artemether) มีค่าเฉลี่ยเวลากำจัดปรสิตเร็วกว่า quinine (53-62 ต่อ 92 ชั่วโมง) และการกำจักไข้ของยาฉีด artesunate โดยใช้เวลาเพียง 80-82 ชั่วโมงในขณะที่ยาฉีด quinine ใช้เวลา 107 ชั่วโมง
ฤทธิ์ยับยั้งเอนไซม์อะซิทิลโคลีนเอสเทอเรส มีการทดสอบการยับยั้งเอนไซม์อะซิทิลโคลีนเอสเทอเรสในหลอดทดลอง (อะซิทิลโคลีนเอสเทอเรส เป็นเอนไซม์ที่ทำลายสารสื่อประสาท acethylcholine ในสมอง ซึ่งก่อให้เกิดโรคความจำเสื่อมอัลไซเมอร์) โดยทดสอบด้วยวิธี Ellman’s colorimetric method ผลการทดสอบพบว่าสารสกัดเอทานอลส่วนเหนือดิน (ใบ และกิ่ง) ก่อนออกดอกของโกฐจุฬาลัมพา (A. annua) ที่ความเข้มข้น 1 mg/mL สามารถยับยั้งการทำงานของเอนไซม์อะซิทิลโคลีนเอสเทอเรสได้ คิดเป็นร้อยละ 71.83 มีค่า IC50 เท่ากับ 87.43 μg/mLในขณะที่ส่วนสกัดย่อย F2 และ F4 ที่ได้จากการแยกสารสกัดเอทานอลด้วยเทคนิค silica gel column chromatography มีฤทธิ์ยับยั้งเอนไซม์อะซิทิลโคลีนเอสเทอเรสสูง โดยมีค่า IC50 เท่ากับ 36.75 และ 28.82 μg/mLตามลำดับ ซึ่งสารบริสุทธิ์ 2 ชนิด ได้แก่ อาร์ทีมิซินิน และ chrysosplenetin ที่แยกได้จากการสกัดเอทานอลจากโกฐจุฬาลัมพาในขนาด 0.1 mg/mL มีฤทธิ์ยับยั้งเอนไซม์อะซิทิลโคลีนเอสเทอเรสสูงที่สุด คิดเป็นร้อยละ 71.67 และ 80.00 ตามลำดับ มีค่า IC50 เท่ากับ 29.34 และ 27.14 μg/mL ตามลำดับ
ฤทธิ์ต้านมะเร็ง ในปี ค.ศ.1992 มีรายงานฤทธิ์ต้านเซลล์มะเร็งเป็นครั้งแรกของอนุพันธุ์อาร์ทีมิชินิน โดยพบว่ายากลุ่มนี้สามารถยับยั้งการเจริญเติบโตของเซลล์มะเร็งหลายชนิด อาทิเช่น มะเร็งเม็ดเลือดขาว มะเร็งปากมดลูก มะเร็งเต้านม มะเร็งสมอง มะเร็งลำไส้ใหญ่ มะเร็งรังไข่ มะเร็งปอด มะเร็งผิวหนัง และมะเร็งต่อมลูกหมาก เป็นต้น ในความเข้มข้นระดับนาโนโมลาร์ถึงไมโครโมลาร์ และยังมีการศึกษาวิจัยโดยนำ artesunate มาทดสอบกับเซลล์มะเร็งจำนวน 60 ชนิด ที่ก่อให้เกิดโรคมะเร็งต่างๆ ทั้งสิ้น 9 โรคได้แก่ มะเร็งปอด มะเร็งผิวหนัง ลำเร็งลำไส้ใหญ่ มะเร็งต่อมลูกหมาก มะเร็งไต มะเร็งเม็ดเลือดขาว มะเร็งรังไข่ มะเร็งสมอง และมะเร็งเต้านม พบว่ามีเซลล์มะเร็งถึง 55 ชนิด ที่ไวต่อยานี้ด้วยความเข้มข้นระดับไมโครโมลาร์ ซึ่งแบ่งได้เป็น 3 กลุ่ม ตามความไวต่อยาจากมากไปน้อย ได้แก่ leukemia และ colon cancer cell (IC50 =1-2 μM)> melanoma, breast, ovarian prostate, CNS และ renal cancer cell> non-small cell lung cancer cell (IC50=26μM)10 ซึ่งเป็นระดับความเข้มข้นเดียวกับยาต้านมะเร็งมาตรฐานอื่นๆ เช่น vincristine, doxorubicin, hydroxyurea และ methotrexate โดยพบว่า artesunate ออกฤทธิ์ได้ดีกว่า artemether และ arteether นอกจากนั้น artesunate สามารถยับยั้งการเจริญเติบโตของเซลล์มะเร็งจากต่อมไทรอยด์ (medullary thyroid carcinoma cells)12 เซลล์มะเร็งชนิด Kaposi’s sarcoma และเซลล์มะเร็งในช่องปากอีกด้วย ส่วน dihydroartemisinin พบว่ามีฤทธิ์ต้านแบ่งตัวของ glioma cells15 และ chronic myeloid leukemia K562 cells นอกจากนี้ยังมีการศึกษาวิจัยทางคลินิกโดย การใช้ artesunate ร่วมกับยาต้านมาตรฐานเพื่อรักษามะเร็ง metastatic uveal melanorma ระยะที่ 4 ในผู้ป่วย 2 รายที่ใช้ยาต้านมะเร็งมาตรฐานเพียงตัวเดียวแล้วไม่ได้ผล ซึ่งในผู้ป่วยรายแรกเมื่อได้รับยา artesunate ร่วมกับยา fotemustine พบว่ามีการตอบสนองต่อยาแต่ไม่สามารถหยุดการพัฒนาของโรคได้ ส่วนผู้ป่วยรายที่ 2 พบว่าการให้ยา artesunate ร่วมกับยา dacarbazine ทำให้การดำเนินของโรคลดลงแม้ว่าสุดท้ายได้มีการกระจายตัวของมะเร็งไปที่ม้ามและปอด แต่พบว่าสามาถทำให้ผู้ป่วยมีอายุนานถึง 47 เดือน เมื่อเปรียบเทียบกับค่าเฉลี่ยทั่วไปที่ 2-5 เดือน ส่วนการศึกษาทางพิษวิทยานั้นได้มีการศึกษาวิจัยโดย กรอกสาร artemisinin ขนาด 1.0 กรัม/กิโลกรัม เข้ากระเพาะอาหารหนูขาว และกระต่าย ติดต่อกัน 14 วัน ไม่พบว่าเป็นพิษ และสาร artemisinin ไม่มีฤทธิ์ก่อกลายพันธุ์ เมื่อทดสอบด้วย Saimonella, mammalian microsomal enzymes และ mouse marrow micronucleus แต่ อีกการศึกษาหนึ่งพบว่าเมื่อให้สาร aetemisinin ขนาด 15 และ 30 มิลลิกรัม/กิโลกรัม เป็นเวลา 7-17 วัน แก่หนูขาวที่ตั้งท้อง พบว่าทำให้ตัวอ่อนตาย
ข้อแนะนำและข้อควรปฏิบัติ
ถึงแม้ว่าจะมีข้อมูลรายงานผลการศึกษาวิจัยที่ได้ระบุถึงฤทธิ์ทางเภสัชวิทยาต่างๆ ของอาร์ทีมิชินิน (artemisinin) ที่น่าสนใจแต่ทั้งนี้สำหรับฤทธิ์ทางเภสัชวิทยาที่มีการรับรองว่าสามารถใช้ได้และมีความปลอดภัยในการใช้ในปัจจุบันนั้นพบว่ามีเพียงฤทธิ์ต้านเชื้อมาลาเรียเท่านั้น ส่วนฤทธิ์ทางเภสัชวิทยาอื่นๆ นั้นพบว่ายังเป็นเพียงการศึกษาในหลอดทดลองและสัตว์ทดลองเท่านั้น อีกทั้งยังขาดการศึกษาวิจัยทางคลินิกที่ชัดเจน รวมถึงยังขาดการศึกษาด้านความปลอดภัย ขนาดและปริมาณ ในการใช้สารดังกล่าวในมนุษย์ แต่สำหรับการใช้สารอาร์ทีมิชินิน ในรูปแบบสมุนไพรจากพืชที่เป็นแหล่งของสารดังกล่าว ก็ยังสามารถใช้ได้ตามขนาดและปริมาณที่กำหนดไว้ในตำรับตำรายาต่างๆ สำหรับในส่วนของการใช้อาร์ทีมิชินิน (Artemisinin) เป็นยารักษาโรคมาลาเรียนั้นมีรายงานระบุว่าสามารถพบความไม่พึงประสงค์และอาการข้างเคียงได้ อาทิเช่น คลื่นไส้ อาเจียน เบื่ออาหาร เวียนศรีษะและปัสสาวะมีสีคล้ำ แต่พบได้น้อยมาก นอกจากนี้สำหรับคนตั้งครรภ์ในช่วง 3 เดือน แรกควรพิจารณาการให้เป็นพิเศษแม้ว่าจะไม่มีรายงานการเกิดผลต่อทารกในครรภ์
เอกสารอ้างอิง อาร์ทีมิชินิน
- บุญใจ ลิ่มศิลา, เย็นจิตร เตชะดำรงสิน, เผิง เฉิง และคณะ (กรมพัฒนาการแพทย์แผนไทยและการแพทย์ทางเลือก กระทรวงสาธารณสุข). 2559. มาตรฐานสมุนไพรจีนในประเทศไทย เล่ม 2. ชุมนุมสหกรณ์การเกษตรแห่งประเทศไทย จำกัด:กรุงเทพมหานคร.
- ฤทธิ์ยับยั้งเชื้อมาลาเรียจากชิงเฮา. ข่าวความเคลื่อนไหวสมุนไพร. สำนักงานข้อมูลสมุนไพร คณะเภสัชศาสตร์ มหาวิทยาลัยมหิดล
- ภญ.อ.ดร.จุรีย์ เจริญธีรบูรณ์. ยากลุ่มอาร์ทีมิชินิน : จากยาฆ่าเชื้อมาลาเรียสู่สารต้านมะเร็ง. วารสารไทยไภษัธยนิพนธ์ ปีที่ 3. สิงหาคม-ตุลาคม 2549. หน้า 95-106
- นันทนา สิทธิชัย. ยาต้านมาลาเรีย: สถานการณ์ปัจจุบัน. วารสารไทยเภสัชสาร ปีที่ 28. ฉบับที่ 3-4 กรกฎาคม-ธันวาคม 2547. หน้า 95-110
- โกศจุฬาลัมพา. ฐานข้อมูลเครื่องยา คณะเภสัชศาสตร์ มหาวิทยาลัยอุบลราชธานี (ออนไลน์). เข้าถึงได้จาก http://www.thaicrudedrug.com/main.php?action = viewpage&pid=28
- Efferth, T. Molecular pharmacology and pharmacogenomics of artemisinin and its derivatives in cancer cells. Curr Drug Targets 2006;7:407-21.
- Woodrow, CJ, Haynes, RK, Krishna, S. Artemisinin. Postgrad Med J 2005; 81:71-8.
- Teja-Isavadharm, P, Watt, G, Eamsila, C et al. Comparative pharmacokinetics and effect kinetics of orally administered artesunate in healthy volunteers and patients with uncomplicated falciparum malaria. Am J Trop. Med Hyg 2001; 65: 717-21.
- Ferreira, J.F.S, Laughlin, C. J., Delabays, N., de Magalhães, P.M. 2005. Cultivation and genetics of Artemisia annua L. for increased production of the antimalarial artemisinin. (Vol. 3). 2005.
- Oda, D, Habte, T, Yamachika, E. Artemisinin: an alternative treatment for oral cancer. Oral surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology 2004; 98:204.
- R. Price, M. van Vugt, L. Phaipun, C. Luxemburger, J. Simpson, R. McGready, F. Ter Kuile, A. Kham, T. Chongsuphajaisiddhi, N. J. White, and F. Nosten. Adverse effects in patients with acute falciparum malaria treated with artemisinin derivatives. Am. J. Trop. Med. Hyg. 60: 547-555 (19991).
- Haynes, RK. Artemisinin and derivatives: the future for malaria treatment? Curr Opin Infect Dis 2001;14:719-26.
- Ribeiro, IR, Olliaro, P. Safety of artemisinin and its derivatives. A review of published and unpublished clinical trials, Med Trop (Mars) 1998;58:50-3.
- De vries, PJ, Tran, KD, Nguyen, XK, et al. The phramacokonetics of a single dose of artemisinin in patients with uncomplicated falciparum malaria. Am J Trop Med Hyg 1997; 56: 503-7.
- Ivanescu, B., Miron, A., Corciova, A. 2015. Sesquiterpene Lactones from Artemisia Genus: Biological Activities and Methods of Analysis. Journal of Analytical Methods in Chemistry, 247685.
- Efferth, T, Dunstan, H, Sauerbrey, A, et al. The anti-malaria artesunate is also active against cancer. Int J Oncol 2001; 18: 767-73.
- AHFS Drug Information, American socirty of Health-System Phramacist, Maryland, 2002, pp. 739-764, 1719-1725.
- Bethell, DB, Teja-Isavadharm, P, Cao, XT, et al. Phramacokinetics of Oral artesunate in children with moderately severe Plasmodium falciparum malaria. Tran R Soc Trop Med Hyg 1997; 91: 195-8.
- Silva LFR, Magalhães PM, Costa MRF, Alecrim MGC, Chaves FCM, Hidalgo AF, et al. In vitro susceptibility of Plasmodium falciparum Welch field isolates to infusions prepared from Artemisia annua L. cultivated in the Brazilian Amazon. Memórias do Instituto Oswaldo Cruz. 2012;107(7):859-866.
- Berger, TG, Dieckmann, D, Efferth, T, et al. Artesunate in the treatment of metastatics uveal melanoma-first experiences. Oncol Rep 2005;14: 1599-603.
- Sun, WC, Han, JX, Yang, WY, et al. [Antitumor activities of 4 derivatives of artemisic acid and artemisinin B in vitro]. Zhongguo Yao Li Xue Bao 1992;13: 541-3.
- D. B. Bethell, P. Teja-isavadharm, C. Xuan Thanh Phuong, P. Thi Thu Thuy, T. Thi Tuyet Mal, T. Thi Nhu Thuy, N. Thi Thanh Ha, P. Tung Phuong, D. Kyle, N. P. J. Day, and N. J. White. Phramacokinetics of Oral artesunate in children wite moderately severe Plasmodium falciparum malaria. Trans. R. Soc. Trop. Med. Hyg. 91: 195-198 (1997).
- Chougouo RDK, Nguekeu YMM, Dzoyem JP, Awouafack MD, Kouamouo J, Tane P, et al. Anti-inflammatory and acetylcholinesterase activity of extract, fractions and five compounds isolated from the leaves and twigs of Artemisia annua growing in Cameroon. SpringerPlus. 2016;5:1525.
- Klayman, D.L. 1985. Qinghaosu (artemisinin): an antimalarial drug from China. Science228(4703),1049-1055.